Ενδοθωρακική υπερθερμική χημειοθεραπεία (HITHOC)
Πλευροδεσία με περιοχική υπερθερμική χημειοθεραπεία
(Το κείμενο προέρχεται από τη διδακτορική διατριβή του Δρ Αθανάσιου Κλέωντα)
Η δράση της υπερθερμίας σε κυτταρικό επίπεδο
Αύξηση της θερμοκρασίας των κυττάρων στην περιοχή των 39-45 oC, μπορεί να προκαλέσει αναστολή του πολλαπλασιασμού τους και κυτταρικό θάνατο. Η ένταση των επιδράσεων εξαρτάται από τον συνδυασμό του ύψους της θερμοκρασίας και του χρόνου έκθεσης των κυττάρων σε αυτή την θερμοκρασία, που μαζί εκφράζονται με τον όρο θερμική δόση (111). Κατά την έκθεση των κυττάρων σε αυξημένη θερμοκρασία επισυμβαίνουν πολλές αλλαγές. Η θερμοκρασία αλλάζει τα χαρακτηριστικά της κυτταρικής μεμβράνης, προκαλώντας τροποποίηση της μορφολογίας του κυττάρου, των ενδοκυτταρικών συγκεντρώσεων των ιόντων καλίου και νατρίου και του δυναμικού της μεμβράνης (112-113). Απροσδόκητα, κανένα από τα προαναφερόμενα φαινόμενα δεν συσχετίζεται άμεσα με τον επερχόμενο κυτταρικό θάνατο και επομένως κανένα από αυτά δεν επεξηγεί επαρκώς τον άμεσο μηχανισμό της θερμικά προκαλούμενης κυτταροτοξικότητας (112-113). Πέρα από τις μεμβράνες, δευτερεύουσες πρωτεϊνικές δομές φαίνεται να είναι περισσότερο ευαίσθητες στην θερμότητα κι ίσως η προκαλούμενη από την θερμότητα πρωτεϊνική μετουσίωση μπορεί να εξηγήσει τις επιπτώσεις της ήπιας υπερθερμίας στα κύτταρα (111). Παρόλο που το DNA δεν καταστρέφεται σε θερμοκρασίες 39-45 oC, εντούτοις η de novo σύνθεση και ο πολυμερισμός του DNA εμφανίζουν ευαισθησία στην θερμότητα, λόγω της προκαλούμενης μετουσίωσης και συσσωμάτωσης των συνθετασών και πολυμερασών (114-115). Το γεγονός αυτό φαίνεται να συμβάλλει σημαντικά σε λειτουργίες του κυτταρικού κύκλου και του κυτταρικού θανάτου. Επίσης προκαλείται διαταραχή των βασικών ενζυμικών λειτουργιών του κυττάρου, όπως η διαδικασία επιδιόρθωσης του DNA. Οι πυρηνίσκοι είναι ευαίσθητοι στην υπερθερμία, όπως επίσης και άλλα ένζυμα που χρησιμοποιούνται στη σύνθεση του RNA. Ακόμη, παρατηρείται ανικανότητα του RNA να αλληλεπιδράσει με πρωτεΐνες, κατά τη διάρκεια της υπερθερμίας (116). Τελικά, μετά από μία επαρκή θερμική δόση, τα κύτταρα οδηγούνται στο θάνατο είτε μέσω της νέκρωσης, όπου το κύτταρο πολύ γρήγορα χάνει την ακεραιότητα της κυτταρικής του μεμβράνης, είτε μέσω της απόπτωσης, όπου εσπευσμένα ενεργοποιείται ο προγραμματισμένος κυτταρικός θάνατος. Κάθε μία από τις δύο αυτές διαδικασίες υπόκειται σε διαφορετικές ανοσορρυθμιστικές δραστηριότητες (117). Στο παρακάτω σχήμα 12, δίδεται έμφαση στους κυριότερους βιολογικούς τρόπους, με τους οποίους η επίδραση της υπερθερμίας προσπαθεί να αποφέρει θεραπευτικά αποτελέσματα, μέσω των εξής ανοσολογικών επιδράσεων (118):
- Έκφραση μορίων MICA, MHC(I) στην επιφάνεια καρκινικών κυττάρων που υποβάλλονται σε υπερθερμία
- Παραγωγή πρωτεϊνών θερμικού σοκ
- Παραγωγή εξωσωμάτων
- Άμεσες επιδράσεις στα ανοσοποιητικά κύτταρα
- Τροποποίηση της αγγείωσης των όγκων
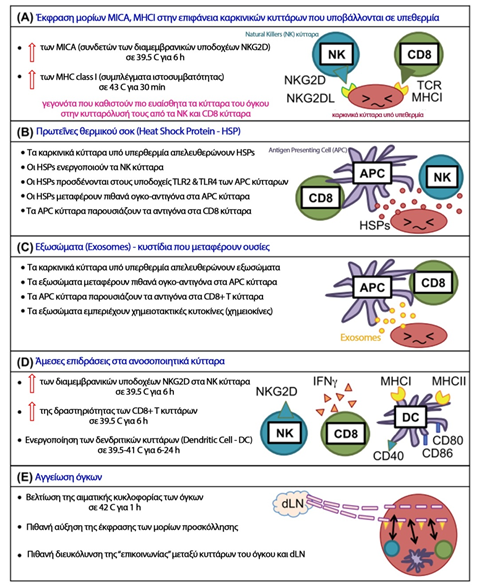
Σχήμα 12
Επαγόμενοι από υπερθερμία μηχανισμοί ενεργοποίησης ανοσοποιητικού συστήματος (118)
Τροποποιημένο από: Fig.1 Local tumour hyperthermia as immunotherapy for metastatic cancer
Seiko Toraya-Brown1 & Steven Fiering
Int J Hyperthermia, 2014; 30(8): 531–539
Η εφαρμογή της υπερθερμίας για θεραπευτικούς σκοπούς
Η υπερθερμία, ως θεραπευτική διαδικασία, επιτελείται με την αύξηση της θερμοκρασίας μιας συγκεκριμένης ανατομικής περιοχής ή ολόκληρου του σώματος, σε επίπεδα ανώτερα της φυσιολογικής θερμοκρασίας, με σκοπό να προκληθούν θεραπευτικά αποτελέσματα στον οργανισμό. Διακρίνονται τρεις διαφορετικές, βασικές κατηγορίες εφαρμογής υπερθερμίας (118):
- Τοπική υπερθερμία
- Περιοχική υπερθερμία
- Ολοσωματική υπερθερμία
Κατά την διαδικασία της τοπικής υπερθερμίας, συνήθως για την αντιμετώπιση νεοπλασιών, η αύξηση της θερμοκρασίας εφαρμόζεται σε ένα συμπαγή όγκο και μπορεί να φτάσει τους 80oC, όταν επιχειρείται η εκτομή (καταστροφή) του όγκου (119) ή μπορεί να κυμαίνεται μεταξύ 41-45oC, όταν σκοπός της είναι να προκληθούν μόνο σοβαρές βλάβες στην φυσιολογία των κυττάρων, που θα οδηγήσουν στον κυτταρικό θάνατο, χωρίς να προκληθούν σοβαροί τραυματισμοί των γειτονικών υγιών ιστών (120).
Στην περιοχική υπερθερμία, η αύξηση της θερμοκρασίας εφαρμόζεται σε μία σχετικά μεγάλη ανατομική περιοχή του σώματος, όπως η περιτοναϊκή κοιλότητα, η υπεζωκοτική κοιλότητα, το άνω ή κάτω άκρο και η θερμοκρασία της επιλεγμένης περιοχής να κυμαίνεται μεταξύ 39-42 oC, ώστε το όφελος να προκύψει από φυσικές επιδράσεις, παρόμοιες με αυτές που προκαλεί ο πυρετός, χωρίς να προκαλείται ιστική βλάβη (118).
Στην ολοσωματική υπερθερμία, ολόκληρο το σώμα εμβαπτίζεται μέσα σε θερμό διάλυμα ή περιτυλίγεται με θερμικές κουβέρτες, για την επίτευξη της υπερθερμίας σε θερμοκρασία που να κυμαίνεται μεταξύ 39-41 oC. Συνήθως η ολοσωματική υπερθερμία συνδυάζεται και με άλλες τεχνικές σε εκτεταμένες, μεταστατικές κακοήθειες (121).
Η υπερθερμία για την αντιμετώπιση νεοπλασιών
Η υπερθερμία εφαρμόζεται θεραπευτικά στην αντιμετώπιση των νεοπλασιών, καθώς η φυσική απόκριση των φυσιολογικών κυττάρων διαφέρει από αυτή των νεοπλασματικών κυττάρων στην επίδραση της υπερθερμίας. Είναι γνωστό ότι η αύξηση της θερμοκρασίας σε έναν ιστό, επιφέρει άμεση και ανάλογη αύξηση της αιματικής του ροής, γεγονός που συνοδεύεται από διαστολή των αγγείων και αύξηση της διαπερατότητας του τοιχώματος των αγγείων, όπως φαίνεται στο γράφημα 1 (122). Συγκριτικά με τους υγιείς ιστούς, τα νεοπλάσματα φαίνεται να εμφανίζουν μειωμένη ικανότητα αύξησης της ροής του αίματος με την αύξηση της θερμοκρασίας. Κατά συνέπεια η διάχυση της θερμότητας μέσω της ροής του αίματος στους όγκους είναι βραδύτερη από την αντίστοιχη στους φυσιολογικούς ιστούς, με αποτέλεσμα οι όγκοι να αναπτύσσουν υψηλότερη θερμοκρασία από τους φυσιολογικούς ιστούς κατά την θέρμανσή τους (υψηλότερη θερμοκρασία επιφέρει μεγαλύτερες καταστροφές), αφού η ελάττωση της αιματικής ροής και επομένως η καθυστέρηση της απομάκρυνσης του αίματος από τον όγκο με τη φλεβική κυκλοφορία, να ελαττώνει και το ρυθμό επιστροφής της θερμοκρασίας του νεοπλασματικού ιστού (heat clearance) στα φυσιολογικά επίπεδα (123). Αυτό σχετίζεται με τις δομικές διαφορές του αγγειακού δικτύου των όγκων, όπου τα νεοσχηματιζόμενα σε ένα νεόπλασμα αγγεία δημιουργούνται από προϋπάρχοντα αγγεία, προσομοιάζουν μορφολογικά με υπερτροφικά τριχοειδή και χαρακτηρίζονται από μερική ή και πλήρη απουσία λείων μυϊκών ινών και περικυττάρων. Λόγω του γεγονότος ότι η αιματική ροή στους όγκους εξαρτάται από το μέγεθός τους και από τον τύπο τους (μεγαλύτερη αιματική ροή παρατηρείται στους μικρούς όγκους), αρκετές φορές παρατηρείται μεγαλύτερη ροή στους όγκους από τους περιβάλλοντες υγιούς ιστούς. Επίσης το αγγειακό δίκτυο των όγκων μπορεί να καταστραφεί σε ορισμένες θερμοκρασίες, ενώ στις ίδιες θερμοκρασίες το αγγειακό δίκτυο των φυσιολογικών ιστών να παρουσιάζει μόνο ελάχιστες αλλοιώσεις (122).
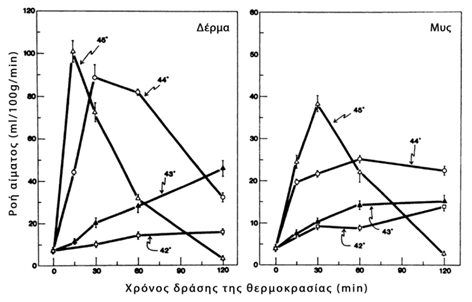
Γράφημα 1
Επίδραση θερμοκρασίας στην ροή του αίματος στους ιστούς (122)
Μεταφρασμένο από: Fig.1 Effect of local hyperthermia on blood flow and microenvironment: a review.
Song CW
Cancer Res. 1984 Oct;44(10 Suppl):4721s-4730s.
Αρχικά παρατηρείται μια αύξηση της αιμάτωσης λόγω αγγειοδιαστολής και μετά από κάποιο χρονικό διάστημα – το οποίο εξαρτάται από το είδος του νεοπλάσματος και το ύψος της θερμοκρασίας – σημειώνεται ελάττωση της αιματικής ροής, η οποία οφείλεται σε παχύνσεις του ενδοθηλίου και μικροθρομβώσεις. Το φαινόμενο αυτό είναι πιο έντονο, όταν η εφαρμοζόμενη θερμοκρασία ξεπερνά τους 42οC και ίσως παίζει ρόλο στο συνδυασμό υπερθερμίας – χημειοθεραπείας, θεωρώντας πως το χημειοθεραπευτικό φάρμακο αφού φτάσει στο νεόπλασμα, λόγω της ελάττωσης στη συνέχεια της αιματικής διήθησης του όγκου θα παραμείνει και θα επιδρά για μεγαλύτερο χρονικό διάστημα σε αυτόν (124).
Συγκριτικές μελέτες σε καλλιέργειες ανθρώπινων φυσιολογικών και νεοπλασματικών κυττάρων, που εκτέθηκαν σε θερμοκρασίες 42.5-43.0οC για 4-8 ώρες, ανέδειξαν υψηλότερα ποσοστά νέκρωσης των νεοπλασματικών κυττάρων με στατιστική σημαντικότητα (p<0.01), όπως διαφαίνεται στο παρακάτω γράφημα 2 (125).
Επίσης παρατηρήθηκε ότι αν και τα νεοπλασματικά κύτταρα έχουν αυξημένη μιτωτική δραστηριότητα, (αλλά μικρότερη από ορισμένα φυσιολογικά κύτταρα, όπως τα μελανοκύτταρα του ραγοειδούς χιτώνα) αυτή δεν σχετίζεται με αυξημένη ευαισθησία στην θερμοκρασία. Δηλαδή η επιλεκτική θερμοευαισθησία των νεοπλασματικών κυττάρων αποτελεί ένα ιδιαίτερο χαρακτηριστικό τους, που σχετίζεται με τον αυξημένο πολλαπλασιασμό τους (125).
Περιοχική χημειοθεραπεία
Η περιοχική χημειοθεραπεία βασίζεται στην ιδέα της βελτίωσης της αποτελεσματικότητας του χημειοθεραπευτικού παράγοντα επί της κακοήθειας, όταν η χορήγηση διενεργείται πλησίον της ανατομικής περιοχής που εδράζεται ο όγκος. Συγκριτικά με την συστηματική χημειοθεραπεία, κατά την διενέργεια περιοχικής χημειοθεραπείας δίδεται η δυνατότητα της χορήγησης υψηλών δόσεων χημειοθεραπευτικών φαρμάκων, σε βραχύ χρονικό διάστημα και επίτευξη υψηλών ιστικών συγκεντρώσεων στην περιοχή του όγκου, με παράλληλο περιορισμό των ανεπιθύμητων, συστηματικών παρενεργειών (126).

Γράφημα 2
Επίδραση θερμοκρασίας στην επιβίωση
υγιών και νεοπλασματικών κυττάρων (125)
Μεταφρασμένο από: Fig.1-4 Selective lethal effect of supranormal temperatures on human neoplastic cells.
Giovanella BC, Stehlin JS Jr, Morgan AC.
Cancer Res. 1976 Nov;36(11 Pt 1):3944-50.
Οι κύριες διαφορές μεταξύ συστηματικής και περιοχικής χημειοθεραπείας αναλύονται ως εξής (127-129):
- Κατά την συστηματική χορήγηση, το φάρμακο κατανέμεται σε όλο το σώμα, ενώ με την περιοχική περιορίζεται σε ένα όργανο ή μια ανατομική περιοχή (π.χ. ήπαρ, άνω ή κάτω άκρο, περιτοναϊκή ή υπεζωκοτική κοιλότητα).
- Κατά τη συστηματική χορήγηση, μία ποσότητα του χημειοθεραπευτικού φαρμάκου (που σε μερικές περιπτώσεις φτάνει το 70%) μεταβολίζεται και αποδομείται (κυρίως στο ήπαρ) πριν φτάσει στο τελικό όργανο στόχο, ενώ κατά την περιοχική χορήγηση, σχεδόν όλη η ποσότητα του φαρμάκου δρα επί του όγκου (αναμένοντας υψηλότερα ποσοστά απόκρισης στη θεραπεία) κι ένα μικρό μόνο ποσοστό του εισέρχεται στη συστηματική κυκλοφορία.
- Με την περιοχική χημειοθεραπεία επιτυγχάνεται συνεχής και για αρκετή ώρα έκθεση των νεοπλασματικών κυττάρων στον χημειοθεραπευτικό παράγοντα. Η περιοχική χορήγηση χαρακτηρίζεται από πολύ μικρότερη έως ανύπαρκτη συστηματική τοξικότητα. Επίσης στην περιοχική χημειοθεραπεία δίνεται η δυνατότητα χορήγησης πολύ υψηλότερων δόσεων (που στην συστηματική χορήγηση θεωρούνται απαγορευτικές λόγω της τοξικότητά τους), με κύριο στόχο η αύξηση της συγκέντρωσης των χημειοθεραπευτικών να υπερνικήσει το πρόβλημα της ανθεκτικότητας του όγκου.
5.3.4.1. Τρόποι χορήγησης περιοχικής χημειοθεραπείας
Υπάρχουν δύο βασικές κατηγορίες περιοχικής χημειοθεραπείας (126):
Η ενδοαγγειακή χορήγηση, η οποία μπορεί να διακριθεί σε:
- Αμιγής ενδαρτηριακή έγχυση (Infusion) – σε πρωτοπαθείς ή μεταστατικούς όγκους
- Συνδυασμός ενδαρτηριακής έγχυσης με χημειοεμβολισμό – σε όγκους του ήπατος
- Ενδαρτηριακή έγχυση – άρδευση με απομόνωση (Isolation Perfusion) – σε σαρκώματα και μελανώματα των άκρων
- Ενδαρτηριακή έγχυση με σύγχρονο αγγειακό αποκλεισμό και υποξαιμία (Stop flow) – σε όγκους της ελάσσονος πυέλου
Η ενδοκοιλοτική χορήγηση, οι οποία εφαρμόζεται σε τρεις διαφορετικές ανατομικές περιοχές: στην περιτοναϊκή κοιλότητα, στην υπεζωκοτική κοιλότητα και ενδοκυστικά (ουροδόχος κύστη).
Κατά την ενδοαγγειακή χορήγηση, χρησιμοποιείται ως αγγείο προσπέλασης είτε:
- το κυρίως τροφοφόρο αγγείο του οργάνου ή του νεοπλάσματος (που δεν είναι απαραιτήτως το ίδιο). Χαρακτηριστικό παράδειγμα αποτελεί η ηπατική αρτηρία στο ήπαρ, διότι αυτή είναι που αρδεύει κυρίως τις μακροσκοπικές μεταστατικές εστίες, αν και χορηγεί μόνο το 14% της συνολικής παρεγχυματικής ηπατικής ροής. Αντιθέτως, τα φυσιολογικά ηπατικά κύτταρα, και κατά συνέπεια οι μικροσκοπικές μεταστατικές εστίες, που δεν έχουν αποκτήσει ακόμη αυτοτελή αιμάτωση, αιματώνονται κυρίως από την πυλαία φλέβα (130-131).
- είτε το αρτηριακό στέλεχος που τροφοδοτεί την ανατομική περιοχή, στην οποία βρίσκεται το όργανο ή το νεόπλασμα-στόχος (καθετηριασμός των έξω λαγόνιων αγγείων για νεοπλάσματα των κάτω άκρων με τη μέθοδο Isolation Perfusion, τεχνική Stop-flow για νεοπλάσματα της ελάσσονος πυέλου με παροδική απόφραξη της κοιλιακής αρτηρίας κλπ).
Στο παρακάτω σχήμα 13, αναδεικνύεται ο τρόπος ενδοαγγειακής, περιοχικής χημειοθεραπείας του κάτω άκρου για την αντιμετώπιση μελανώματος του κάτω άκρου (132).

Σχήμα 13
Περιοχική χημειοθεραπεία κάτω άκρου (132)
Μεταφρασμένο από: Fig.2 Management of In-Transit Malignant Melanoma
Paul J. Speicher, Douglas S. Tyler and Paul J. Mosca
ISBN 978-953-51-0961-7
Η ενδοκοιλοτική χορήγηση χημειοθεραπευτικών φαρμάκων αφορά κυρίως στην περιτοναϊκή και την υπεζωκοτική κοιλότητα. Η ομοιογενής κατανομή του χημειοθεραπευτικού διαλύματος όπως είναι φυσικό, περιορίζεται από την ύπαρξη συμφύσεων μεταξύ των ελίκων του εντέρου ή μεταξύ ελίκων και κοιλιακού τοιχώματος στην περίπτωση της περιτοναϊκής κοιλότητας και μεταξύ του πνεύμονα και του θωρακικού τοιχώματος, του μεσοθωρακίου και του διαφράγματος στην περίπτωση της υπεζωκοτικής κοιλότητας. Στο ακόλουθο σχήμα 14, διακρίνεται η περιοχική ενδοθωρακική χημειοθεραπεία με θωρακοσκοπική τοποθέτηση των σωλήνων του κυκλώματος (133).
Οι ασθενείς με πρωτοπαθείς όγκους του υπεζωκότα, μεταστατικούς όγκους του υπεζωκότα και μεταστατική κακοήθη πλευριτική συλλογή συνήθως έχουν δυσμενή πρόγνωση, με ποσοστό μέσης επιβίωσης που κυμαίνεται μεταξύ 6-18 μηνών. Γι’ αυτό ο συνδυασμός κυτταρομειωτικής (ογκομειωτικής), χειρουργικής επέμβασης με περιοχική, ενδοϋπεζωκοτική χημειοθεραπεία και ακολούθως με συστηματική χημειοθεραπεία χρησιμοποιείται ολοένα και συχνότερα για τον τοπικό έλεγχο της νόσου (1, 104).

Σχήμα 14
Περιοχική χημειοθεραπεία υπεζωκοτικής κοιλότητας (133)
Μεταφρασμένο από: Fig.2 Clinical outcomes of cytoreductive surgery combined with intrapleural perfusion of hyperthermic chemotherapy in advanced lung adenocarcinoma with pleural dissemination
Eunjue Yi , Daejoong Kim , Sukki Cho, Kwhanmien Kim, Sanghoon Jheon
J Thorac Dis. 2016 Jul; 8(7): 1550–1560.
Συνδυασμός περιοχικής υπερθερμίας και χημειοθεραπείας
Κλασικές μελέτες έχουν αποδείξει την αξιοσημείωτη, συνεργική δράση υπερθερμίας και χημειοθεραπείας. Μία υπεραπλουστευμένη εξήγηση της συνέργειας αυτής είναι ότι: η χημειοθεραπεία παρόλο που προκαλεί σοβαρές βλάβες στα νεοπλασματικά κύτταρα, αυτά διατηρούν την δυνατότητά τους να επιδιορθώσουν τις προκληθείσες βλάβες – στο σημείο αυτό δρα συνεργικά η υπερθερμία, η οποία αναστέλλει τους μηχανισμούς επιδιόρθωσης, με αποτέλεσμα τα νεοπλασματικά κύτταρα να οδηγηθούν στο θάνατο. Μάλιστα στη συνεργική αυτή δράση αποδίδεται ο όρος της «θερμοχημειοθεραπείας» (134). Στο παρακάτω γράφημα 3, φαίνεται ότι η προκλητή θνητότητα των νεοπλασματικών κυττάρων αυξάνεται με την συνεργική δράση της υπερθερμίας και χημειοθεραπείας κι είναι ανάλογη της θερμοκρασίας και της συγκέντρωσης του χημειοθεραπευτικού (134).
Επίσης, άλλες ερευνητικές μελέτες έχουν αναδείξει την αύξηση της κυτταροτοξικότητας ορισμένων χημειοθεραπευτικών παραγόντων (όπως docetaxel, paclitaxel, irinotecan, oxaliplatin, gemcitabine), όταν αυτοί δρουν σε συνθήκες ήπιας υπερθερμίας (41.5oC), λόγω αυξημένης διείσδυσης στους όγκους (135). Γι’ αυτό, την τελευταία 20ετία, η διεγχειρητική, περιοχική, ενδοπεριτοναϊκή, υπερθερμική χημειοθεραπεία, που ακολουθεί την ογκομειωτική χειρουργική έχει διενεργηθεί σε περιπτώσεις κακοήθους μεσοθηλιώματος, ψευδομυξώματος του περιτοναίου και περιτοναϊκής διασποράς καρκίνου του παχέος εντέρου, του στομάχου και των ωοθηκών, με πολύ καλά αποτελέσματα, αναφορικά με την συνολική επιβίωση, το χρονικό διάστημα ελεύθερο νόσου και τον τοποπεριοχικό έλεγχο της νόσου (136-140).
Αντίθετα, η διεγχειρητική, περιοχική, ενδοθωρακική (ενδοϋπεζωκοτική ή ενδοπλευρική), υπερθερμική χημειοθεραπεία δεν είναι τόσο ευρέως διαδεδομένη και εφαρμοσμένη και οι μελέτες που ασχολούνται με το θέμα είναι περιορισμένες (4, 141). Η πρώτη σχετική δημοσίευση έγινε το 1995 από την ομάδα των Matsuzaki et al (142) κι έκτοτε έχουν δημοσιευτεί περίπου 30 άρθρα (4).
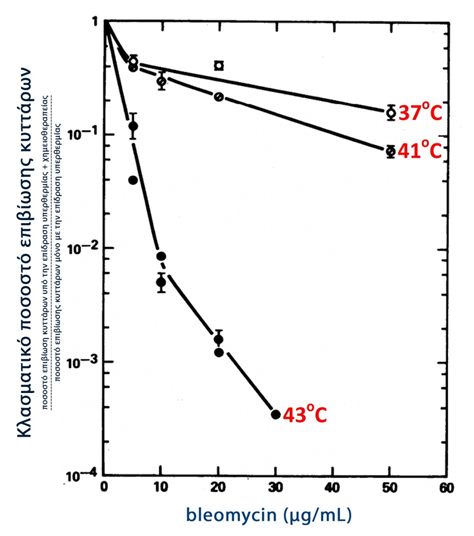
Γράφημα 3
Επιβίωση νεοπλασματικών κυττάρων υπό την συνεργική επίδραση
χημειοθεραπείας και υπερθερμίας (134)
Μεταφρασμένο από: Fig.1 Thermochemotherapy: synergism between hyperthermia (42-43 degrees) and adriamycin (of bleomycin) in mammalian cell inactivation.
Hahn GM, Braun J, Har-Kedar I.
Proc Natl Acad Sci U S A. 1975 Mar;72(3):937-40.
Η υπερθερμική ενδοθωρακική χημειοθεραπεία στην αντιμετώπιση της κακοήθους πλευριτικής συλλογής
Η υπερθερμική, ενδοθωρακική χημειοθεραπεία (Hyperthermic IntraTHOracic Chemotherapy – HITHOC – ή Intrapleural Perfusion ThermoChemotherapy – IPTC) ξεκίνησε και συνεχίζει να χρησιμοποιείται κυρίως διεγχειρητικά μετά από κυτταρομειωτική, χειρουργική επέμβαση, όταν δεν είναι δυνατό να επιτευχθεί R0 (ριζική) εκτομή όγκων με πρωτοπαθή εστία στον πνεύμονα, τον υπεζωκότα και το θύμο αδένα ή μεταστατικών όγκων με διασπορά στην υπεζωκοτική κοιλότητα, που προέρχονται από το μαστό και τις ωοθήκες(4-6, 143). Στον παρακάτω πίνακα 6 παρουσιάζονται οι πέντε μοναδικές συγκριτικές μελέτες της βιβλιογραφίας, η μετανάλυση των οποίων καταδεικνύει την στατιστικά σημαντική υπεροχή (p<0.001) της τεχνικής HITHOC, ως προς την μέση επιβίωση, το ποσοστό επιβίωσης στον 1ο χρόνο, την περίοδο ελεύθερη νόσου και την κλίμακα Karnofsky (4).
Ειδικότερα στις περιπτώσεις αντιμετώπισης των θυμικών καρκινωμάτων με συνοδή κακοήθη πλευριτική συλλογή, τα αποτελέσματα της HITHOC σε συνδυασμό με κυτταρομειωτική χειρουργική έδειξαν μέση επιβίωση 18-54 μήνες (144-146). Στην υπεροχή της HITHOC κατέληξε και η μετανάλυση μελετών όπου η τεχνική HITHOC εφαρμόστηκε, πάλι σε συνδυασμό με κυτταρομειωτική επέμβαση, σε ασθενείς με κακόηθες μεσοθηλίωμα του υπεζωκότα (147).
Στην μεταστατική, κακοήθη, πλευριτική συλλογή από μη μικροκυτταρικό καρκίνο του πνεύμονα, η τεχνική HITHOC έχει εφαρμοστεί θωρακοσκοπικά (VATS) με μεγάλη επιτυχία, χωρίς μείζονες επιπλοκές και μέση επιβίωση 21.7 μήνες, ποσοστό επιβίωσης στον 1ο χρόνο 74.1% και τέλος αύξηση του performance status σε ποσοστό 89.3%. Αυτό καθιστά την τεχνική HITHOC-VATS (IPTC-VATS) μια νέα, ασφαλή, λιγότερο επεμβατική και περισσότερο αποτελεσματική μέθοδο αντιμετώπισης της κακοήθους πλευριτικής συλλογής, σε ασθενείς με καρκίνο του πνεύμονα (148).
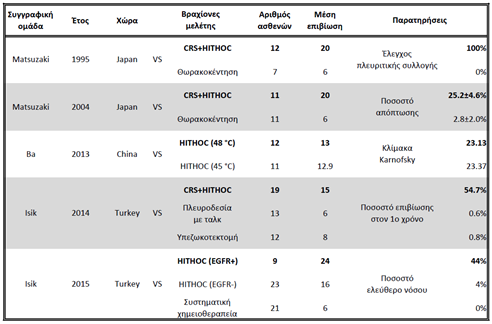
CRS: CytoReductive Surgery (Κυτταρομειωτική ή Ογκομειωτική Χειρουργική)
HITHOC: Hyperthermic IntraTHOracic Chemotherapy (Υπερθερμική Ενδοθωρακική Χημειοθεραπεία
EGFR: Epithermal Growth Factor Receptor (Υποδοχέας Επιδερμικού Αυξητικού Παράγοντα)
Πίνακας 6: Μετανάλυση συγκριτικών μελετών όπου εφαρμόστηκε HITHOC
Οι χημειοθεραπευτικοί παράγοντες που έχουν χρησιμοποιηθεί στην τεχνική HITHOC είναι η σισπλατίνη, η δοξορουβικίνη και η μιτομυκίνη C σε θερμοκρασίες 41-43oC (4). Μάλιστα έχει υπολογισθεί ότι η σισπλατίνη με την βοήθεια της υπερθερμίας μπορεί να διεισδύσει μέχρι 3-4mm σε βάθος από την ελεύθερη επιφάνεια του πνευμονικού παρεγχύματος (149). Ο συνδυασμός δύο χημειοθεραπευτικών φαίνεται να υπερτερεί του ενός, χωρίς να έχει πιστοποιηθεί από μεγάλες μελέτες (150).
Η εφαρμογή της HITHOC προκαλεί μια προσωρινή δυσλειτουργία στην μικροκυκλοφορία των ιστικών δομών όπου εφαρμόζεται, η οποία σταδιακά αποκαθίσταται μετά την πάροδο 72 ωρών (151). Οι κύριες επιπλοκές που έχουν καταγραφεί μετά την διενέργεια της HITHOC είναι εμπύημα, αιμορραγία, διαφυγή αέρος, κολπική μαρμαρυγή, πνευμονική εμβολή, θωρακικό άλγος, πυρετός, δύσπνοια, βρογχοπλευρικό συρίγγιο, σε πολύ μικρά ποσοστά, ενώ έχει παρατηρηθεί ήπια καρδιοτοξικότητα μόνο στην περίπτωση συγχορήγησης δύο χημειοθεραπευτικών παραγόντων (σισπλατίνη + δοξορουβικίνη) (4, 152). Η θνητότητα που σχετίζεται με την τεχνική είναι μηδενική, ακόμα κι όταν η τεχνική επαναληφθεί πέντε φορές στον ίδιο ασθενή, όπως συμβαίνει σε ένα μεγάλο κέντρο της Κίνας, όπου η τεχνική εφαρμόζεται υπό τοπική αναισθησία στο κρεβάτι του ασθενούς (153).
Την τελευταία 10ετία, λόγω των εξαιρετικών αποτελεσμάτων της μεθόδου στην επιμήκυνση της επιβίωσης, αλλά και στην βελτίωση της ποιότητας ζωής των ασθενών, στη Γερμανία υφίστανται 17 θωρακοχειρουργικά τμήματα που εφαρμόζουν την μέθοδο κι έχουν ήδη διενεργήσει περισσότερες από 350 επεμβάσεις (154).
Στην χώρα μας η μέθοδος έχει γίνει αποδεκτή από το Υπουργείο Υγείας το 2011 και εφαρμόζεται σε περιορισμένα κέντρα (Αρ.Πρωτ:Υ4α/οικ.131099, 29.11.2011).
Σύμφωνα με τα αποτελέσματα της διδακτορικής διατριβής του Θωρακοχειρουργού Αθανάσιου Κλέωντα, όπως αυτά ανακοινώθηκαν σε έγκριτο διεθνές επιστημονικό το 2019, η ενδοθωρακική, υπερθερμική χημειοθεραπεία αποτελεί μια καλή κι ασφαλή θεραπευτική επιλογή, στην αντιμετώπιση ασθενών με κακοήθη πλευριτική συλλογή, σε έδαφος μη μικροκυτταρικού καρκίνου του πνεύμονα, με αποδεκτή επιβίωση.

Επισκεφθείτε τον ιατρό.
Ο Χειρουργός Θώρακος, Αθανάσιος Κλέωντας κατά τις πρωινές ώρες βρίσκεται στο χώρο του Ιατρικού Διαβαλκανικού Κέντρου Θεσσαλονίκης και τις απογευματινές ώρες στο ιατρείο του (Ερμού 73).
📞 2310 – 400000
Γραφείο 11, 2ος όροφος. Dec 1742
ΑΘΑΝΑΣΙΟΣ Δ. ΚΛΕΩΝΤΑΣ
ΩΡΑΡΙΟ ΙΑΤΡΟΥ
Ο ιατρός βρίσκεται τηλεφωνικά στη διάθεσή σας 24 ώρες την ημέρα, επτά μέρες την εβδομάδα.
Δέχεται στο ιατρείο του κατόπιν ραντεβού:
Δευτέρα – Παρασκευή: 18.00 – 21.00
